Разширено съхранение на енергия
| Advanced Energy Storage е въведение в системите за съхранение на енергия за електрически превозни средства. Той обхваща основите на преобразуването на енергия, включително термодинамиката, химическото съхранение на енергия в горивата и водорода, електрохимичните системи за съхранение на енергия, химичните реакции в батериите при зареждане и разреждане на батерии и устойчивостта на модерните системи за съхранение на енергия. Тук също така, ще сравним въздействието върху околната среда на настоящите енергийни системи, захранвани с изкопаеми горива и процесите на преобразуване с по-устойчиви системи, използващи възобновяема енергия и по-ефективните процеси на преобразуване. |
1.Анализиране на понятията за валентност
Анализирайте как подреждането на елементите в периодичната таблица е свързано с валентните електрони, химичното свързване и стехиометрията в химичните реакции.
Този урок обсъжда периодичната таблица на елементите и концепцията за валентност (коефициентът пред вид в химическо уравнение), тъй като се отнася до химичните връзки и стехиометрията. Тази информация е крайъгълен камък за разбиране на химичните процеси, при изгаряне на горивото и сравняването му с химичните процеси, протичащи в различни батерии и водородни горивни клетки. За да разберем изгарянето на горива за производство на топлинна енергия, трябва да разберем защо елементите се комбинират в определени пропорции, за да образуват стабилни продукти. Това включва две основни концепции: (1) валентни електрони и (2) стехиометрия .
За да обясним валентността, използваме позицията на елементите в периодичната таблица на елементите. Елементите се комбинират, за да образуват химични съединения с химични връзки, в които отделните атоми са запълнили външните обвивки от електрони. Атомите могат да получават или губят електрони, което води до йони с пълни външни обвивки (йонно свързване) или да споделят електрони, за да имат запълнени външни обвивки (ковалентно свързване). Образуването на химични връзки между атомите, което води до запълнени външни електронни обвивки, определя пропорциите на елементите в съединенията. Това е първата стъпка към писането на балансирани химически уравнения, описващи превръщането на реагентите в продукти. Същите концепции също ще бъдат използвани, за да се разбере електрохимичните процеси, възникващи в батериите и горивните клетки.
Валансови електрони
Нека започнем с периодичната таблица на елементите, показани по-долу.
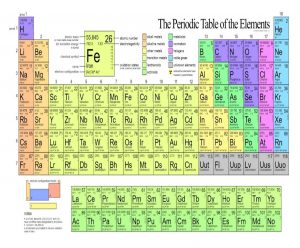 Таблица 1. Периодичната таблица на елементите
Таблица 1. Периодичната таблица на елементите
Позиционирането на всеки елемент в редовете и колоните може да се използва за разбиране на валентността на този елемент. Химиците подреждат елементите в периодичната таблица въз основа на техните тегла и химични свойства, без да разбират техните електронни конфигурации. Те знаеха, че определени групи елементи имат сходни свойства и това знание доведе до колони от елементи: елементите в колона имат сходни химични и дори физични свойства. През 20-те години на миналия век, физиците разработват квантовата теория, която обяснява, че елементите са съставени от заредени частици, протони и електрони, а електроните са подредени в обвивки или орбитали, които описват разрешените енергийни състояния на атома.
Това може да се илюстрира, като се започне с така наречения атом на Бор. Въпреки че тази концепция е заменена от по-сложна квантова теория, наречена вълнова механика, атомът на Бор все още е много полезна концепция в химията. Най-простият атом на Бор, този за водородния атом, е показан на фигура 1.

Фигура 1. Модел на атома на Бор
На фигура 1 има един електрон, обикалящ около един протон, подобно на луната, обикаляща около Земята. Това обаче не е стабилна химическа система – това е единичен валентен електрон. За да постигне стабилност, водородният атом трябва да получи друг електрон във външната си обвивка. Тогава би бил като хелий – инертен газ. Един от начините да направите това е да споделите електрон с друг водороден атом. Химиците биха написали това:
| H + H – H 2 |
или на фигура 2, показваща електроните във водородните атоми и водородната молекула:

Фигура 2. Електроните във водородните атоми и водородната молекула.
Всъщност водородът съществува като двуатомен газ. Нека започнем анализът на периодичната таблица с елементите в колоната най-вдясно. Това са инертните газове, наречени така, защото се съпротивляват на образуването на всякакви химически връзки. Те имат електронни конфигурации, свързани с голяма химическа стабилност. Другите елементи могат да постигнат стабилност само чрез получаване или споделяне на електрони и те правят това, използвайки най-външните или валентни електрони. Например, нека разгледаме лития (Li) и флуора (F). За да обясним валентността на тези системи, трябва да представим орбиталите и тяхната номенклатура от квантовата теория. Електроните се поставят в обвивките и орбиталите, предвидени от квантовата теория, започвайки с s орбитала, p орбитала и т.н. Първата обвивка има само една орбитала, s орбитала, и всяка орбитала може да побере два електрона. Втората обвивка има две орбитали, s и p, и има 3 p орбитали. По този начин втората обвивка може да съдържа 8 електрона. Двете черупки, които описахме, са всичко, което е необходимо до този момент, за да се разбере химична система, в която се комбинират литий и флуор. За да се изгради електронната конфигурация на лития, електроните се поставят в орбиталите, както следва. Литият има общо три електрона, така че неговата електронна конфигурация е 1s2 2s 1 . Първата запълнена обвивка е точно като хелия с два електрона и електронна конфигурация 1s 2 . В първо приближение единственият електрон от значение за химичните свойства на Li е 2s 1 електронът. Елементите в първата колона на периодичната таблица (Li, Na, K, Rb, Cs, Fr) имат един единствен най-външен електрон и всички имат сходни химични свойства. Най-външният електрон или електроните в елемента, които са от основно значение при определянето на неговите химични свойства, се наричат валентни електрони.
Сега нека разгледаме електронната конфигурация на флуора. Флуорът има електронна конфигурация от 1s 2 2s 2 2p 5 . Флуорът има седем валентни електрона и се нуждае от още един електрон, за да постигне запълнена външна обвивка като инертния газ, неона, директно отдясно в периодичната таблица.
Какъв тип химически продукти и съотношение на комбиниране бихме очаквали, ако комбинираме литий и флуор? Литият има един валентен електрон; ако може да се отърве от този електрон, за да образува положителен йон, Li+, той ще има запълнена външна обвивка, 1s 2 , електронна конфигурация като хелий и инертен газ. Флуорът има седем валентни електрона; ако може да получи още един електрон, той ще образува отрицателен йон, F-, и ще има запълнена външна обвивка като неон. Всъщност Li и F образуват йонно съединение с формула LiF, наречено литиев флуорид. Същите тези разсъждения могат да обяснят съединенията, образувани от всички алкални метали в първата колона на периодичната таблица (Li, Na) с някой от халогените в предпоследната колона на периодичната таблица (F, Cl, Br , I, As).
Съединения като LiF, в които се образуват йонни връзки, се дисоциират във вода, за да образуват йони, които провеждат електричество. Това е важно свойство на такива съединения и те могат да се използват като електролити в батериите.
Съотношенията на комбиниране на елементите със себе си, като комбиниране на два водородни атома, или един с друг, като комбинацията на един литиев атом с един флуорен атом, се нарича стехиометрия на химическа реакция. В първо приближение той се определя от валентните електрони, тъй като те са електроните, които се прехвърлят от един атом на друг или се споделят между атомите, за да образуват химични връзки.
Стехиометрия
Стехиометрията е химическата аритметика, която се използва от химиците за запис на балансирани химически уравнения. Важно е да се разбере концепцията за валентност, за да се разбере защо елементите се комбинират в определени пропорции, за да образуват стабилно съединение и след това да се напишат балансирани химически уравнения за този процес. Нека разгледаме комбинацията от водород и кислород за образуване на вода. Тази химическа реакция се използва в горивните клетки за производство на електричество. Първо, водородът съществува като двуатомен газ, както беше обсъдено по-рано. Кислородът съществува и като диатоничен газ. Така продуктите в нашата реакция са водород, H 2 и кислород, O 2. Водородът има един валентен електрон, а кислородът – шест. Така че, ако два водородни атома споделят своите електрони с един кислороден атом, ще се образуват две връзки, така че водата има формулата H 2 O.
Това би било написано:
| 2 H 2 + O 2 → 2 H 2 O |
Малкият индекс до химически символ показва, че два атома са комбинирани в молекула, докато двата пред химическите символи за вода показват, че две молекули вода се произвеждат всеки път, когато реакцията настъпи. В реакцията не е показан фактът, че химическата енергия под формата на топлина или електричество се произвежда спонтанно от тази реакция. Количеството произведена енергия е важно за нашето разбиране за преобразуване на енергия. Също така, валентността и стехиометрията на реакцията са важни за свързването на количествата на реагентите (водород и кислород) с енергията, която може да се получи.
Изчисляване на потенциална и кинетична енергия
Енергията е способността за извършване на работа. Енергията има няколко форми и може да се преобразува от една форма в друга. По време на такива преобразувания енергията се запазва, което означава, че енергията нито се създава, нито се разрушава, тя просто си променя формите. Например, първият закон на термодинамиката гласи, че енергията се запазва, когато топлината се превърне в работа или обратно.
Може би най-добрата и фундаментална илюстрация на запазването на енергията е преобразуването между потенциална и кинетична енергия. Потенциалната енергия е енергията на позицията или състава, докато кинетичната енергия е енергията на движението. Например водата на върха на водопад, има потенциална енергия. Докато тече над водопада, потенциалната енергия се преобразува в кинетична енергия в дъното на водопада. В този урок ще изследваме физическите и математическите връзки, между потенциалната и кинетичната енергия като първа стъпка в разбирането на запазването на енергията.
Ключови понятия:
- Потенциалната и кинетичната енергия са двете основни форми на енергия.
- Потенциалната енергия може да се преобразува в кинетична енергия и обратно.
- Енергията се запазва в процеса на преобразуване.
- Гравитационната потенциална енергия осигурява практична система за съхранение на енергия в резервоари.
Гравитационна потенциална енергия
Гравитационната потенциална енергия е енергията на позицията или състава. Неподвижната маса е изцяло потенциална и не се движи, така че нейната механична енергия е изцяло потенциална енергия, а не кинетична енергия. Като се има предвид отново водопад, потенциалната енергия на водата на върха на водопада е енергията на позицията на масата (вода) в гравитационното поле на Земята. Водата се притегля от гравитацията на Земята, за да тече надолу над водопада.
Гравитационната потенциална енергия е представена от следното уравнение. Потенциалната енергия, E p , е равна на масата (m 1 ) по ускорението на гравитацията (g) – обикновено се дава като 9,8 метра/секунда 2 и съкратено до 9,8 m/s 2 – по височината (h) над повърхността на Земята.
Уравнение 1: Гравитационна потенциална енергия
Гравитационна потенциална енергия = E p = m 1 X g X h
Съгласно уравнението, когато една маса е в покой, на земната повърхност, нейната потенциална енергия е 0. Знаем това, защото масата е на земята, така че височината й над земната повърхност е 0 метра. Всяко количество, умножено по 0, води до 0, така че масата по ускорението на гравитацията по( 0) метра е равно на 0 потенциална енергия. Масата е неподвижна и не може да извършва никаква работа.
Ако масата се издигне над нулевата си позиция обаче, нейната потенциална енергия се увеличава. Това е така, защото поради гравитацията сега има потенциал да извършва работа. Ако масата се освободи, тя ще се ускори към земната повърхност; когато удари повърхността, ще има кинетична енергия и може да извършва работа като забиване на пирон в парче дърво. Казано по-просто, масата на височина има потенциал за движение и следователно потенциал за извършване на работа.
Например, на фигура 1, маса от 1 килограм, представена с кръг, каца на скала, измерена на 10 метра над земната повърхност. Преди масата да падне, цялата й механична енергия е потенциална енергия, а не кинетична енергия. Използвайки уравнението, че потенциалната енергия е равна на масата по ускорението на гравитацията по височината, ние изчисляваме: Ep = m 1 X g X h = 1 kg x 9,8 m/s 2 x 10 m = 98 kg/m 2 /s 2 Един kg m/s 2 се нарича Нютон (съкратено N), а Nm (kg/m 2 /s 2 ) се нарича джаул. Следователно, потенциалната енергия на тази маса се изчислява като 98 kg/m 2 /s 2 и се съкращава до 98 джаула.
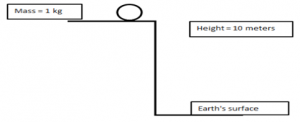 Фигура 1. Неподвижна маса от 1 kg на височина 10 метра над Земята.
Фигура 1. Неподвижна маса от 1 kg на височина 10 метра над Земята.
Кинетична енергия
Кинетичната енергия, от друга страна, е енергията на движението. Например водата, която тече в поток, има кинетична енергия и може да върши работа, като задвижване на лодка или завъртане на водно колело. Кинетичната енергия на обект зависи от масата на обекта, m 1 , и неговата скорост v, както е показано в следното уравнение:
Уравнение 2: Кинетична енергия
Кинетична енергия = E k = ½ X m 1 X v 2
По този начин кинетичната енергия на обект се увеличава с квадрата на скоростта.
Преобразуване на потенциална в кинетична енергия
Връзката между общата енергия, потенциалната енергия и кинетичната енергия за система, състояща се от маса, m1, на височина, h, над повърхността на Земята, може да се използва, за да се илюстрира как се запазва енергията, когато има промени в потенциална и кинетична енергия. Този проблем има голяма практическа стойност във водноелектрическата енергия, където се използва потенциалната енергия на водата. Ако водата тече над значителен спад, като например водопад, може да се изгради язовир и капката вода може да се използва контролирано. Тъй като водата пада през вертикална тръба, където потенциалната й енергия намалява, нейната кинетична енергия се увеличава и тя работи, завъртайки турбина, свързана с електрически генератор в долната част на тръбата.
Помислете отново за системата на фигура 1 по-горе, където масата от 1 kg на височина 10 метра над земната повърхност пада на земята. Ако масата се освободи, колко кинетична енергия ще има масата, когато се удари в земната повърхност? Първоначално цялата енергия в системата е потенциалната енергия на масата поради нейното положение. Докато пада, потенциалната енергия намалява, а кинетичната енергия се увеличава, докато общата енергия остава същата. Диаграма, показваща потенциалната и кинетичната енергия, както и общата енергия (сумата от потенциалната и кинетичната енергия) за тази система, е дадена на фигура 2 по-долу.
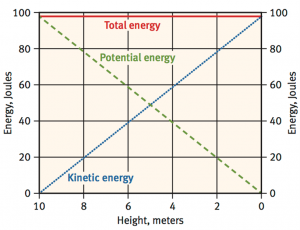
Фигура 2. Потенциална енергия, кинетична енергия и обща енергия на маса от 1 kg първоначално на 10 метра над земната повърхност (като функция на височината след падането й от 10-метрова височина).
Забележете, че тъй като масата от 1 kg се изпуска от 10 метра височина и пада на повърхността на Земята, нейната потенциална енергия намалява от 100 на 0 джаула, докато нейната кинетична енергия се увеличава от 0 до 100 джаула. Намаляващата потенциална енергия и нарастващата кинетична енергия се пресичат под формата на „X“. Тъй като масата удря земната повърхност, тя има 100% кинетична енергия: нейната потенциална енергия е 0 джаула, а нейната кинетична енергия е 100 джаула. Също така имайте предвид, че когато масата пада и нейната енергия се преобразува от потенциална в кинетична енергия, общата енергия в системата остава постоянна при 100 джаула.
Решение за скорост
Общата енергия в системата остава постоянна, тъй като при преобразуването на енергията от потенциална в кинетична енергия не се създава или губи. Остава само постоянна, на което физиците казват, че общата енергия се запазва“. Можем да използваме този принцип, за да изчислим скоростта на масата, точно когато се удря в земята. Преди масата да падне, тя има 100% потенциална енергия и 0% кинетична енергия. В нашия пример масата от 1 kg има 98 джаула потенциална енергия. Когато масата удря земната повърхност, нейната енергия се е променила на 0% потенциална енергия и 100% кинетична енергия. Така че сега масата от 1 kg има 98 джаула кинетична енергия.
Не забравяйте, че уравнението за кинетичната енергия е:
E k = ½ X m 1 X v 2 .
Знаем, че E k в този пример е 98 джаула, което е равно на 98 kg m 2 /s 2 .
Поради това:
½ x 1 kg xv 2 = 98 kg m 2 /s 2
Решаването на това уравнение за v 2 дава:
v 2 = 196 m 2 /s 2
така че v = 14 m/s.
 ENGINEERING AND TECHNOLOGY IN TRANSPORT Diagnostics and repair
ENGINEERING AND TECHNOLOGY IN TRANSPORT Diagnostics and repair